Газообразные состояние вещества.
Насыщенный и ненасыщенный пар.
Давление насыщенного пара и его зависимость от температуры.
Зависимость давления насыщенного пара от температуры. Состояние насыщенного пара, как показывает опыт (мы говорили об этом в предыдущем параграфе), приближенно описывается уравнением состояния идеального газа (10.4), а его давление определяется формулой
С ростом температуры давление растет. Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
Однако зависимость рн.п. от Т, найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объеме. С увеличением температуры давление реального насыщенного пара растет быстрее, чем давление идеального газа (рис.11.1, участок кривой АВ). Это становится очевидным, если провести изохоры идеального газа через точки А и В (штриховые прямые). Почему это происходит?
При нагревании жидкости в закрытом сосуде часть жидкости превращается в пар. В результате согласно формуле (11.1) давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. В основном увеличение давления при повышении температуры определяется именно увеличением концентрации. Главное различие в поведении идеального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объема при постоянной температуре) меняется масса пара. Жидкость частично превращается в пар, или, напротив, пар частично конденсируется. С идеальным газом ничего подобного не происходит.
Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропорционально абсолютной температуре (см. рис.11.1, участок кривой ВС).
Кипение.
По мере увеличения температуры жидкости интенсивность испарения увеличивается. Наконец, жидкость начинает кипеть. При кипении по всему объему жидкости образуются быстро растущие пузырьки пара, которые всплывают на поверхность. Температура кипения жидкости остается постоянной. Это происходит потому, что вся подводимая к жидкости энергия расходуется на превращение ее в пар. При каких условиях начинается кипение?
В жидкости всегда присутствуют растворенные газы, выделяющиеся на дне и стенках сосуда, а также на взвешенных в жидкости пылинках, которые являются центрами парообразования. Пары жидкости, находящиеся внутри пузырьков, являются насыщенными. С увеличением температуры давление насыщенных паров возрастает и пузырьки увеличиваются в размерах. Под действием выталкивающей силы они всплывают вверх. Если верхние слои жидкости имеют более низкую температуру, то в этих слоях происходит конденсация пара в пузырьках. Давление стремительно падает, и пузырьки захлопываются. Захлопывание происходит настолько быстро, что стенки пузырька, сталкиваясь, производят нечто вроде взрыва. Множество таких микровзрывов создает характерный шум. Когда жидкость достаточно прогреется, пузырьки перестанут захлопываться и всплывут на поверхность. Жидкость закипит. Понаблюдайте внимательно за чайником на плите. Вы обнаружите, что перед закипанием он почти перестает шуметь.
Зависимость давления насыщенного пара от температуры объясняет, почему температура кипения жидкости зависит от давления на ее поверхность. Пузырек пара может расти, когда давление насыщенного пара внутри него немного превосходит давление в жидкости, которое складывается из давления воздуха на поверхность жидкости (внешнее давление) и гидростатического давления столба жидкости.
Обратим внимание на то, что испарение жидкости происходит при температурах, меньших температуры кипения, и только с поверхности жидкости, при кипении образование пара происходит по всему объему жидкости.
Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости.
Чем больше внешнее давление, тем выше температура кипения. Так, в паровом котле при давлении, достигающем 1,6•106 Па, вода не кипит и при температуре 200°С. В медицинских учреждениях в герметически закрытых сосудах - автоклавах (рис.11.2) кипение воды также происходит при повышенном давлении. Поэтому температура кипения жидкости значительно выше 100°С. Автоклавы применяют для стерилизации хирургических инструментов и др.
И наоборот, уменьшая внешнее давление, мы тем самым понижаем температуру кипения. Откачивая насосом воздух и пары воды из колбы, можно заставить воду кипеть при комнатной температуре (рис.11.3). При подъеме в горы атмосферное давление уменьшается, поэтому уменьшается температура кипения. На высоте 7134 м (пик Ленина на Памире) давление приближенно равно 4•104 Па (300 мм рт. ст.). Вода кипит там примерно при 70°С. Сварить мясо в этих условиях невозможно.
У каждой жидкости своя температура кипения, которая зависит от давления ее насыщенного пара. Чем выше давление насыщенного пара, тем ниже температура кипения жидкости, так как при меньших температурах давление насыщенного пара становится равным атмосферному. Например, при температуре кипения 100°С давление насыщенных паров воды равно 101 325 Па (760 мм рт. ст.), а паров ртути - всего лишь 117 Па (0,88 мм рт. ст.). Кипит ртуть при температуре 357°С при нормальном давлении.
Жидкость закипает, когда давление ее насыщенного пара становится равно давлению внутри жидкости.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса).
Критическое состояние.
Диаграмма состояний вещества.


Тройная точка.
Тройна́я то́чка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов. Тройная точка — это одна из характеристик вещества. Обычно тройная точка определяется значением температуры и давления, при котором вещество может равновесно находиться в трёх (отсюда и название) агрегатных состояниях: твёрдом, жидком и газообразном. В этой точке сходятся линии плавления, кипения и сублимации.

Влажность воздуха.
Влажность воздуха — это величина, характеризующая содержание водяных паров в атмосфере Земли - одна из наиболее существенных характеристик погоды и климата.
Точка росы.
Измерение влажности воздуха.
Газ (газообразное состояние) (от нидерл. gas, восходит к др.-греч. χάος) — агрегатное состояние вещества, характеризующееся очень слабыми связями между составляющими его частицами (молекулами, атомами или ионами), а также их большой подвижностью. Частицы газа почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения.
Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества, обычно называется паром.
Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного объёма[1] и не образуют свободной поверхности, а стремятся заполнить весь доступный объём (например, сосуда).
Газообразное состояние — самое распространённое состояние вещества Вселенной (межзвёздное вещество, туманности,звёзды, атмосферы планет и т. д.). По химическим свойствам газы и их смеси весьма разнообразны — от малоактивныхинертных газов до взрывчатых газовых смесей. Понятие «газ» иногда распространяют не только на совокупности атомов и молекул, но и на совокупности других частиц — фотонов, электронов, броуновских частиц, а также плазму .
Насыщенный и ненасыщенный пар.
Насы́щенный пар — это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава[1].
Давление насыщенного пара связано определённой для данного вещества зависимостью от температуры. Когда внешнее давление падает ниже давления насыщенного пара, происходит кипение (жидкости) или возгонка (твёрдого тела); когда оно выше — напротив, конденсация или десублимация.
Ненасыщенный пар — пар, не достигший термодинамического равновесия со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
Давление насыщенного пара и его зависимость от температуры.
Зависимость давления насыщенного пара от температуры. Состояние насыщенного пара, как показывает опыт (мы говорили об этом в предыдущем параграфе), приближенно описывается уравнением состояния идеального газа (10.4), а его давление определяется формулой
С ростом температуры давление растет. Так как давление насыщенного пара не зависит от объема, то, следовательно, оно зависит только от температуры.
Однако зависимость рн.п. от Т, найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объеме. С увеличением температуры давление реального насыщенного пара растет быстрее, чем давление идеального газа (рис.11.1, участок кривой АВ). Это становится очевидным, если провести изохоры идеального газа через точки А и В (штриховые прямые). Почему это происходит?
При нагревании жидкости в закрытом сосуде часть жидкости превращается в пар. В результате согласно формуле (11.1) давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул (плотности) пара. В основном увеличение давления при повышении температуры определяется именно увеличением концентрации. Главное различие в поведении идеального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объема при постоянной температуре) меняется масса пара. Жидкость частично превращается в пар, или, напротив, пар частично конденсируется. С идеальным газом ничего подобного не происходит.
Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропорционально абсолютной температуре (см. рис.11.1, участок кривой ВС).
Кипение.
По мере увеличения температуры жидкости интенсивность испарения увеличивается. Наконец, жидкость начинает кипеть. При кипении по всему объему жидкости образуются быстро растущие пузырьки пара, которые всплывают на поверхность. Температура кипения жидкости остается постоянной. Это происходит потому, что вся подводимая к жидкости энергия расходуется на превращение ее в пар. При каких условиях начинается кипение?
В жидкости всегда присутствуют растворенные газы, выделяющиеся на дне и стенках сосуда, а также на взвешенных в жидкости пылинках, которые являются центрами парообразования. Пары жидкости, находящиеся внутри пузырьков, являются насыщенными. С увеличением температуры давление насыщенных паров возрастает и пузырьки увеличиваются в размерах. Под действием выталкивающей силы они всплывают вверх. Если верхние слои жидкости имеют более низкую температуру, то в этих слоях происходит конденсация пара в пузырьках. Давление стремительно падает, и пузырьки захлопываются. Захлопывание происходит настолько быстро, что стенки пузырька, сталкиваясь, производят нечто вроде взрыва. Множество таких микровзрывов создает характерный шум. Когда жидкость достаточно прогреется, пузырьки перестанут захлопываться и всплывут на поверхность. Жидкость закипит. Понаблюдайте внимательно за чайником на плите. Вы обнаружите, что перед закипанием он почти перестает шуметь.
Зависимость давления насыщенного пара от температуры объясняет, почему температура кипения жидкости зависит от давления на ее поверхность. Пузырек пара может расти, когда давление насыщенного пара внутри него немного превосходит давление в жидкости, которое складывается из давления воздуха на поверхность жидкости (внешнее давление) и гидростатического давления столба жидкости.
Обратим внимание на то, что испарение жидкости происходит при температурах, меньших температуры кипения, и только с поверхности жидкости, при кипении образование пара происходит по всему объему жидкости.
Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости.
Чем больше внешнее давление, тем выше температура кипения. Так, в паровом котле при давлении, достигающем 1,6•106 Па, вода не кипит и при температуре 200°С. В медицинских учреждениях в герметически закрытых сосудах - автоклавах (рис.11.2) кипение воды также происходит при повышенном давлении. Поэтому температура кипения жидкости значительно выше 100°С. Автоклавы применяют для стерилизации хирургических инструментов и др.
И наоборот, уменьшая внешнее давление, мы тем самым понижаем температуру кипения. Откачивая насосом воздух и пары воды из колбы, можно заставить воду кипеть при комнатной температуре (рис.11.3). При подъеме в горы атмосферное давление уменьшается, поэтому уменьшается температура кипения. На высоте 7134 м (пик Ленина на Памире) давление приближенно равно 4•104 Па (300 мм рт. ст.). Вода кипит там примерно при 70°С. Сварить мясо в этих условиях невозможно.
У каждой жидкости своя температура кипения, которая зависит от давления ее насыщенного пара. Чем выше давление насыщенного пара, тем ниже температура кипения жидкости, так как при меньших температурах давление насыщенного пара становится равным атмосферному. Например, при температуре кипения 100°С давление насыщенных паров воды равно 101 325 Па (760 мм рт. ст.), а паров ртути - всего лишь 117 Па (0,88 мм рт. ст.). Кипит ртуть при температуре 357°С при нормальном давлении.
Жидкость закипает, когда давление ее насыщенного пара становится равно давлению внутри жидкости.
Уравнение состояния реального газа (уравнение Ван-дер-Ваальса).
Для 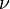 молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
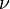 молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
- где
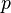 — давление,
— давление,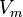 — молярный объём,
— молярный объём, — абсолютная температура,
— абсолютная температура,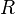 — универсальная газовая постоянная.
— универсальная газовая постоянная.
Критическое состояние.
Диаграмма состояний вещества.
При описании состояния вещества и его фазовых переходов обычно используются переменные  и
и  , в которых изображаются кривые равновесия при фазовых переходах данного вещества. Диаграмма, построенная в этих переменных, называется диаграммой состояния. Каждой точке на этой диаграмме соответствует определенное равновесное состояние. Она позволяет определить, какие фазовые переходы происходят при тех или иных процессах.
, в которых изображаются кривые равновесия при фазовых переходах данного вещества. Диаграмма, построенная в этих переменных, называется диаграммой состояния. Каждой точке на этой диаграмме соответствует определенное равновесное состояние. Она позволяет определить, какие фазовые переходы происходят при тех или иных процессах.
 и
и  , в которых изображаются кривые равновесия при фазовых переходах данного вещества. Диаграмма, построенная в этих переменных, называется диаграммой состояния. Каждой точке на этой диаграмме соответствует определенное равновесное состояние. Она позволяет определить, какие фазовые переходы происходят при тех или иных процессах.
, в которых изображаются кривые равновесия при фазовых переходах данного вещества. Диаграмма, построенная в этих переменных, называется диаграммой состояния. Каждой точке на этой диаграмме соответствует определенное равновесное состояние. Она позволяет определить, какие фазовые переходы происходят при тех или иных процессах.
Рассмотрим случай термодинамической системы, в которой в равновесии находятся сразу три фазы однородного по физико-химическим свойствам вещества (например: лед, вода и пар). Равновесие такой системы будет наблюдаться при одновременном выполнении трех условий, соответствующих равновесию этих фаз между собой. Эти условия в общем виде можно записать в форме
Равенства (7.52) приводят к системе из двух независимых уравнений
Решение этой системы уравнений при условии отсутствия химических превращений дает совершенно определенные значения давления  и температуры
и температуры  , при которых три фазы могут существовать одновременно. Точка на диаграмме состояния в переменных
, при которых три фазы могут существовать одновременно. Точка на диаграмме состояния в переменных  и
и  (см. рис. 7.6), соответствующая указанным значениям давления и температуры, называется тройной точкой. В этой точке встречаются кривая плавления 1, разделяющая твердую и жидкую фазы, кривая испарения 2, разделяющая жидкую и газообразную фазы, и кривая возгонки 3, разделяющая твердую и газообразную фазы.
(см. рис. 7.6), соответствующая указанным значениям давления и температуры, называется тройной точкой. В этой точке встречаются кривая плавления 1, разделяющая твердую и жидкую фазы, кривая испарения 2, разделяющая жидкую и газообразную фазы, и кривая возгонки 3, разделяющая твердую и газообразную фазы.
 и температуры
и температуры  , при которых три фазы могут существовать одновременно. Точка на диаграмме состояния в переменных
, при которых три фазы могут существовать одновременно. Точка на диаграмме состояния в переменных  и
и  (см. рис. 7.6), соответствующая указанным значениям давления и температуры, называется тройной точкой. В этой точке встречаются кривая плавления 1, разделяющая твердую и жидкую фазы, кривая испарения 2, разделяющая жидкую и газообразную фазы, и кривая возгонки 3, разделяющая твердую и газообразную фазы.
(см. рис. 7.6), соответствующая указанным значениям давления и температуры, называется тройной точкой. В этой точке встречаются кривая плавления 1, разделяющая твердую и жидкую фазы, кривая испарения 2, разделяющая жидкую и газообразную фазы, и кривая возгонки 3, разделяющая твердую и газообразную фазы.
Кривая испарения 2 заканчивается критической точкой (К), в которой исчезают отличия жидкой и газообразной фаз. Если фазовый переход осуществляется в обход критической точки, как показано пунктирной линией на рис. 7.6, то пересечения кривой испарения не происходит и фазовое превращение проходит путем непрерывных изменений без образования границы раздела фаз.
Для однородного по своим физико-химическим свойствам вещества в равновесии одновременно могут находиться не более трех фаз. Это означает, что для равновесной системы могут существовать только точки, в которых сходятся три фазы вещества, например, соответствующие трем его агрегатным состояниям. Точки, в которых могли бы одновременно существовать более трех фаз, не реализуемы.
Вещество в трех различных агрегатных состояниях может наблюдаться и при значениях температуры и давления, не соответствующих тройной точке. Например, в природе при различных погодных условиях наблюдаются одновременно лед, вода и водяной пар (последний, как правило, косвенным образом). Однако, в отличие от состояния в тройной точке, указанные состояния не являются равновесными, и для них характерен постоянный переход вещества из одной фазы в другую.
Значения давления и температуры в тройной точке для различных веществ очень стабильны, что позволяет использовать тройную точку для калибровки различных температурных шкал. Тройная точка воды используется в качестве основной реперной точки для температурных шкал Кельвина и Цельсия (см. параграф 1.3).
Отличительной особенностью гелия, диаграмма состояния которого схематически изображена на рис. 7.7, является отсутствие тройной точки, соответствующей одновременному равновесному существованию твердой, жидкой и газообразной фаз.

Из рис. 7.7 следует, что кривые плавления и испарения у гелия не пересекаются, так как твердая фаза образуется только при давлении свыше 25 атм, а при давлении менее 25 атм гелий остается жидким вплоть до абсолютного нуля температуры (это свойство гелия объясняется с использование квантовой механики). Однако это не означает, что у него нет тройных точек. Дело в том, что гелий имеет две жидкие фазы: Не I и Не II, отличающиеся по своим свойствам. Изображенные на рис. 7.7 точки А и В являются тройными, где сосуществуют в равновесном состоянии три фазы: Не I , Не II и, соответственно, - кристаллический гелий (точка А) или газообразный гелий (точка В). Температура, соответствующая точке В, равна приблизительно 2,2 К.
Как правило, все твердые вещества имеют несколько фазовых состояний, обусловленных различными кристаллическими модификациями, структурно отличающимися между собой. Эти фазы могут точно так же находиться в состоянии равновесия между собой, как и фазы, связанные с различными агрегатными состояниями. На диаграмме состояния условиям равновесия этих фаз соответствуют кривые равновесия при фазовых переходах. Существуют тройные точки, в которых могут одновременно находиться в равновесии три фазы, две из которых представляют собой кристаллические модификации, а одна либо жидкая, либо газообразная. У некоторых веществ тройные точки наблюдаются при равновесии трех различных кристаллических модификаций.
Свойство вещества иметь несколько кристаллических модификаций называется полиморфизмом. Этим свойством, например, обладают сера, углерод, олово и железо. Лед имеет несколько кристаллических модификаций. Фазовый переход из одной кристаллический модификации в другую называется полиморфным превращением, которое в большинстве случаев является фазовым переходом первого рода и сопровождается поглощением или выделением теплоты.
Для различных кристаллических модификаций характерно существование метастабильных состояний, то есть таких состояний, при которых одна фаза существует в области температур и давлений другой фазы. Такие же метастабильные состояния существуют и для фазовых переходов из одного агрегатного состояния в другое вблизи тройной точки.
На рис. 7.8 схематически изображены области метастабильных состояний при фазовом переходе жидкость-газ. Выше линии 2 находится область, соответствующая переохлажденному пару, а ниже - перегретой жидкости. Вещество в указанных метастабильных состояниях используется в таких физических приборах как камера Вильсона и пузырьковая камера, принципы работы которых рассматриваются ниже.
Если изобразить изотермы двухфазной системы жидкость-газ (см. рис. 7.9), то горизонтальная часть изотерм будет соответствовать фазовому переходу вещества, справа от горизонтальной части лежат изотермы газовой фазы, а слева - жидкой. Пунктирные линии соответствуют метастабильным состояниям. Справа - переохлажденный пар, слева - перегретая жидкость. Эти состояния будут возникать в том случае, если зародыши другой фазы (капли и пузырьки соответственно) отсутствуют или у них имеется тенденция к исчезновению. Так как образованию зародышей способствуют всякого рода примеси и неоднородности, то метастабильные состояния свойственны хорошо очищенным веществам.
Тройная точка.
Тройна́я то́чка — точка на фазовой диаграмме, где сходятся три линии фазовых переходов. Тройная точка — это одна из характеристик вещества. Обычно тройная точка определяется значением температуры и давления, при котором вещество может равновесно находиться в трёх (отсюда и название) агрегатных состояниях: твёрдом, жидком и газообразном. В этой точке сходятся линии плавления, кипения и сублимации.

Влажность воздуха.
Влажность воздуха — это величина, характеризующая содержание водяных паров в атмосфере Земли - одна из наиболее существенных характеристик погоды и климата.
Точка росы.
Температура точки росы газа (точка росы) — это значение температуры газа, ниже которой водяной пар, содержащийся в газе, охлаждаемом изобарически, становится насыщенным над плоской поверхностью воды[1].
Точка росы определяется относительной влажностью воздуха. Чем выше относительная влажность, тем точка росы выше и ближе к фактической температуре воздуха. Чем ниже относительная влажность, тем точка росы ниже фактической температуры. Если относительная влажность составляет 100 %, то точка росы совпадает с фактической температурой.
Формула для приблизительного расчёта точки росы в градусах Цельсия (только для положительных температур):
где
- Tp = точка росы,
- a = 17.27,
- b = 237,7 °C,
 ,
,- T = температура в градусах Цельсия,
- RH = относительная влажность в объёмных долях (0 < RH < 1.0),
- ln — натуральный логарифм.
Формула обладает погрешностью ±0.4 °C в следующем диапазоне значений:
- 0 °C < T < 60 °C
- 0.01 < RH < 1.0
- 0 °C < Tр < 50 °C
Измерение влажности воздуха.
Определение влажности воздуха
Сначала измеряют температуру воздуха ртутным термометром и записывают показание. Это так называемая показание сухого термометра. Затем плотно обертывают головку термометра мокрой марлей и спустя 10 минут снимают показания мокрого термометра.
Теперь из первой цифры необходимо вычесть вторую, после чего по разности определить относительную влажность по таблице.
Произведя такое определение в солнечный, немного морозный день, вы удивитесь результатам, так как в помещении влажность воздуха будет порядка 25%, а то и ниже — то есть, такая же, как и в пустыне. По сути — это признаки засухи, когда пыль прилипает к вертикальным поверхностям полированной мебели, а белье сохнет практически мгновенно. При таком «климате» молодые растения испытывают тяжелейший водный стресс, а от стресса до болезни – рукой подать. Бороться с этим можно по-разному, например, устанавливать ванночки на шкафах, разбрызгивать воду из пульверизатора, развешивать мокрые полотенца по батареям — все это даст малый эффект.
Пожалуй, единственный прием, позволяющий в значительной степени повысить влажность воздуха, заключается в следующем. Возле батареи на полу необходимо поставить длинный балконный вазон либо другую емкость аналогичной.




 .
. ,
, .
.
