Силы межмолекулярного взаимодействия.
Агрегатные состояние вещества.
Характер теплового движения молекул в твердых, жидких, газообразных телах и его изменение с ростом температуры.
Тепловое движение в твердых телах является в основном колебательным. При высоких
температурах интенсивное тепловое движение мешает сближению молекул – газообразное
состояние, движение молекул поступательное и вращательное. . В газах менее 1% объема
приходится на объем самих молекул. При промежуточных значениях температур
молекулы будут непрерывно перемещаться в пространстве, обмениваясь местами, однако
расстояние между ними не намного превышает d – жидкость. Характер движения молекул
в жидкости носит колебательный и поступательный характер ( в тот момент, когда они
перескакивают в новое положение равновесия).
Тепловое расширение тел.
Тепловое движение молекул объясняет явление теплового расширения тел. При
нагревании амплитуда колебательного движения молекул увеличивается, что приводит к
увеличению размеров тел.
Линейное расширение твердых тел при нагревании.
Линейное расширение твердого тела описывается формулой: L=L0(1+at) , где a - коэффициент линейного расширения ~10^-5 К^-1.
Объемное тепловое расширение твердых тел и жидкостей.
Объемное расширение тел описывается аналогичной формулой: V = V0(1+Bt), B- коэффициент объемного расширения, причем B=3a.
Переходы между агрегатными состояниями.
Вещество может находится в твердом, жидком, газообразном состояниях. Эти
состояния называют агрегатными состояниями вещества. Вещество может переходить из
одного состояния в другое. Характерной особенностью превращения вещества является
возможность существования стабильных неоднородных систем, когда вещество может
находится сразу в нескольких агрегатных состояниях. При описании таких систем
пользуются более широким понятием фазы вещества. Например, углерод в твердом
агрегатном состоянии может находится в двух различных фазах – алмаз и графит. Фазой
называется совокупность всех частей системы, которая в отсутствии внешнего
воздействия является физически однородной. Если несколько фаз вещества при данной
температуре и давлении существуют, соприкасаясь друг с другом, и при этом масса одной
фазы не увеличивается за счет уменьшения другой, то говорят о фазовом равновесии.

Теплота фазового перехода.
Равновесие фаз.
Уравнение теплового баланса.
Если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма полученных Qnи отданных Q0 энергий равна нулю:
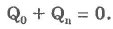
Межмолекулярное взаимодействие имеет электрическую природу. Между ними действуют силы притяжения и отталкивания, которые быстро убывают при увеличении расстояния между молекулами. Силы отталкивания действуют только на очень малых расстояниях. Практически поведение вещества и его агрегатное состояние определяется тем, что является доминирующим: силы притяжения или хаотическое тепловое движение. В твердых телах доминируют силы взаимодействия, поэтому они сохраняет свою форму.
Агрегатные состояние вещества.
Агрега́тное состоя́ние вещества (лат. aggrego 'присоединяю') — состояние одного и того же вещества в определённом интервале температур и давлений, характеризующееся определёнными, неизменными в пределах указанных интервалов, качественными свойствами:
- способностью (твёрдое тело) или неспособностью (жидкость, газ, плазма) сохранять объём и форму,
- наличием или отсутствием дальнего (твёрдое тело) и ближнего порядка (жидкость), и другими свойствами.
Характер теплового движения молекул в твердых, жидких, газообразных телах и его изменение с ростом температуры.
Тепловое движение в твердых телах является в основном колебательным. При высоких
температурах интенсивное тепловое движение мешает сближению молекул – газообразное
состояние, движение молекул поступательное и вращательное. . В газах менее 1% объема
приходится на объем самих молекул. При промежуточных значениях температур
молекулы будут непрерывно перемещаться в пространстве, обмениваясь местами, однако
расстояние между ними не намного превышает d – жидкость. Характер движения молекул
в жидкости носит колебательный и поступательный характер ( в тот момент, когда они
перескакивают в новое положение равновесия).
Тепловое расширение тел.
Тепловое движение молекул объясняет явление теплового расширения тел. При
нагревании амплитуда колебательного движения молекул увеличивается, что приводит к
увеличению размеров тел.
Линейное расширение твердых тел при нагревании.
Линейное расширение твердого тела описывается формулой: L=L0(1+at) , где a - коэффициент линейного расширения ~10^-5 К^-1.
Объемное тепловое расширение твердых тел и жидкостей.
Объемное расширение тел описывается аналогичной формулой: V = V0(1+Bt), B- коэффициент объемного расширения, причем B=3a.
Вещество может находится в твердом, жидком, газообразном состояниях. Эти
состояния называют агрегатными состояниями вещества. Вещество может переходить из
одного состояния в другое. Характерной особенностью превращения вещества является
возможность существования стабильных неоднородных систем, когда вещество может
находится сразу в нескольких агрегатных состояниях. При описании таких систем
пользуются более широким понятием фазы вещества. Например, углерод в твердом
агрегатном состоянии может находится в двух различных фазах – алмаз и графит. Фазой
называется совокупность всех частей системы, которая в отсутствии внешнего
воздействия является физически однородной. Если несколько фаз вещества при данной
температуре и давлении существуют, соприкасаясь друг с другом, и при этом масса одной
фазы не увеличивается за счет уменьшения другой, то говорят о фазовом равновесии.

Теплота фазового перехода.
Теплота́ фа́зового перехо́да — количество теплоты, которое необходимо сообщить веществу (или отвести от него) при равновесном изобарно-изотермическом переходе вещества из одной фазы в другую (фазовом переходе I рода — кипении, плавлении, кристаллизации, полиморфном превращении и т. п.).
Для фазовых переходов II рода теплота фазового превращения равна нулю.
Равновесный фазовый переход при данном давлении происходит при постоянной температуре — температуре фазового перехода. Теплота фазового перехода равна произведению температуры фазового перехода на разность энтропий в двух фазах, между которыми происходит переход.
Различают удельную и мольную теплоту фазового перехода, отнесённые соответственно к 1 кг и 1 молю вещества.
Равновесие фаз.
Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механическогои химического равновесия.
Типы фазовых равновесий:
Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру.
Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением.
Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества.
Уравнение теплового баланса.
Если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма полученных Qnи отданных Q0 энергий равна нулю:
Полученная Qn и отданная Q0 теплоты численно равны, но Qn берется со знаком плюс, a Q0 - со знаком минус.