Состояние термодинамической системы.
Термодинамическая система — это процесс или среда, которая используется при анализе передачи энергии. Термодинамическая система — это любая зона или пространство, ограниченное действительными или воображаемыми границами, выбранными для анализа энергии и ее преобразования. Границы ее могут быть неподвижными или подвижными.
Газ в металлическом сосуде является примером системы с неподвижными границами. Если необходимо проанализировать газ в баллоне для хладагента, стенки сосуда — это неподвижные границы. Если необходимо проанализировать воздух в воздушном шаре, поверхность воздушного шара — подвижная граница. Если нагреть воздух в воздушном шаре, эластичные стенки шарика растягиваются, и граница системы меняется с расширением газа.
Пространство, смежное с границей, называется средой. У всех термодинамических систем есть среда, которая может являться источником теплоты или забирать ее. Среда может также проделать работу над системой или испытывать на себе работу системы.
Системы могут быть большими или маленькими, в зависимости от границ. Например, система может охватывать всю холодильную систему или газ в одном из цилиндров компрессора. Она может существовать в вакууме или может содержать несколько фаз одного или более веществ. Следовательно, действительные системы могут содержать сухой воздух и водяной пар (два вещества) или воду и водяной пар (две стадии одного и того же вещества). Однородная система состоит из одного вещества, одной его фазы или однородной смеси нескольких компонентов.
Системы бывают замкнутыми или открытыми. В замкнутой только энергия пересекает ее границы. Следовательно, теплота может переходить через границы замкнутой системы в среду или из среды в систему.
В открытой системе и энергия, и масса могут переходить из системы в среду и обратно. При анализе насосов и теплообменников необходима открытая система, так как жидкости должны пересекать границы при анализе. Если массовый расход открытой системы устойчивый и однородный, то ее называют открытой системой с постоянным расходом. Массовый расход показывает, открыта или закрыта она.
Состояние термодинамической системы определяется физическими свойствами вещества. Температура, давление, объем, внутренняя энергия, энтальпия и энтропия — это свойства, определяющие состояние, при котором существует вещество. Так как состояние системы — это состояние равновесия, его можно определить, только когда свойства системы стабилизированы и больше не изменяются.
Другими словами, состояние системы можно описать, когда она находится в состоянии равновесия с окружающей средой.
Равновесное состояние.
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объём,энтропия) в условиях изолированности от окружающей среды. В общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений. Если равновесной системе соответствует несколько состояний, в каждом из которых система может находиться неопределенно долго, то о системе говорят, что она находится в метастабильном равновесии. В состоянии равновесия в системе отсутствуют потоки материи или энергии, неравновесные потенциалы (или движущие силы), изменения количества присутствующих фаз. Отличают тепловое, механическое, радиационное (лучистое) и химическое равновесия. На практике условие изолированности означает, что процессы установления равновесия протекают гораздо быстрее, чем происходят изменения на границах системы (то есть изменения внешних по отношению к системе условий), и осуществляется обмен системы с окружением веществом и энергией. Иными словами, термодинамическое равновесие достигается, если скорость релаксационных процессов достаточно велика (как правило, это характерно для высокотемпературных процессов) либо велико время для достижения равновесия (этот случай имеет место в геологических процессах).
В реальных процессах часто реализуется неполное равновесие, однако степень этой неполноты может быть существенной и несущественной. При этом возможны три варианта:
- равновесие достигается в какой-либо части (или частях) относительно большой по размерам системы — локальное равновесие,
- неполное равновесие достигается вследствие разности скоростей релаксационных процессов, протекающих в системе — частичное равновесие,
- имеют место как локальное, так и частичное равновесие.
В неравновесных системах происходят изменения потоков материи или энергии, или, например, фаз.
Состояние термодинамического равновесия называется устойчивым, если в этом состоянии не происходит изменения макроскопических параметров системы.
Критерии термодинамической устойчивости различных систем:
- Изолированая (абсолютно не взаимодействующая с окружающей средой) система — максимум энтропии.
- Замкнутая (обменивается с термостатом только теплом) система — минимум свободной энергии.
- Система с фиксированными температурой и давлением — минимум потенциала Гиббса.
- Система с фиксированными энтропией и объёмом — минимум внутренней энергии.
- Система с фиксированными энтропией и давлением — минимум энтальпии.
Обратимые процессы.
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
Следует отметить, что термодинамическая обратимость процесса отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая — способ его проведения.
Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики применимы только к равновесным состояниям и обратимым процессам.
Термодинамические параметры газа.
| Параметр | Обозначение | Единицы в СИ |
| Масса молекулы | M0 | Кг |
| Скорость молекулы | М/c | |
| Cредняя квадратичная скорость движения молекул | М/c | |
| Средняя кинетическая энергия поступательного движения | Дж |
Таблица. Макропараметры состояния
| Параметр | Обозначение | Единицы в СИ | Способ измерения (косвенный способ) |
| Масса газа | M | Кг | Весы |
| Объем сосуда | V | М3 | Мерный цилиндр с водой; измерение размеров и расчет по формулам геометрии |
| Давление | P | Па | Манометр |
| Температура | T | К | Термометр |
| Плотность | | Кг/м3 | Измерение массы, объема и расчет |
| Концентрация | N | 1/м3 = м-3 | Измерение плотности и расчет с учетом молярной массы |
| Cостав (молярная масса и соотношение количеств ) | М1, М2,
1: 2
| Кг/моль
безразмерная
| Приготовление газа смешением заданных масс или объемов |
Изопроцессы и их графики.
Абсолютный нуль.
Абсолю́тный нуль температу́ры (реже — абсолютный ноль температуры) — минимальный предел температуры, которую может иметь физическое тело во Вселенной. Абсолютный нуль служит началом отсчёта абсолютной температурной шкалы, например, шкалы Кельвина. В 1954 X Генеральная конференция по мерам и весам установила термодинамическую температурную шкалу с одной реперной точкой — тройной точкой воды, температура которой принята 273,16 К (точно), что соответствует 0,01 °C, так что по шкале Цельсия абсолютному нулю соответствует температура −273,15 °C.
Термодинамическая температурная шкала.
Термодинамическая температурная шкала |
Абсолютная температурная шкала, основанная на закономерности цикла Карно и не связанная с каким-либо термометрическим веществом. Она строится на основании соотношения, выполняющегося в процессе цикла Карпо,
Температуры, определяемые теми или иными эталонными термометрами (газовыми, термометрами сопротивления), приводятся к термодинамической шкале.
|
Связь между температурой и кинетической энергией молекул.
E=(3/2)*k*T
В однородном идеальном газе, находящемся при абсолютной температуре  , энергия, приходящаяся на каждую поступательную степень свободы, равна, как следует из распределения Максвелла,
, энергия, приходящаяся на каждую поступательную степень свободы, равна, как следует из распределения Максвелла, 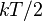 . При комнатной температуре (300 К) эта энергия составляет
. При комнатной температуре (300 К) эта энергия составляет  Дж, или 0,013 эВ. В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в
Дж, или 0,013 эВ. В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в  .
.
 , энергия, приходящаяся на каждую поступательную степень свободы, равна, как следует из распределения Максвелла,
, энергия, приходящаяся на каждую поступательную степень свободы, равна, как следует из распределения Максвелла, 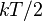 . При комнатной температуре (300 К) эта энергия составляет
. При комнатной температуре (300 К) эта энергия составляет  Дж, или 0,013 эВ. В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в
Дж, или 0,013 эВ. В одноатомном идеальном газе каждый атом обладает тремя степенями свободы, соответствующими трём пространственным осям, что означает, что на каждый атом приходится энергия в  .
.
Зная тепловую энергию, можно вычислить среднеквадратичную скорость атомов, которая обратно пропорциональна квадратному корню атомной массы. Среднеквадратичная скорость при комнатной температуре изменяется от 1370 м/с для гелия до 240 м/с для ксенона. В случае молекулярного газа ситуация усложняется, например, двухатомный газ имеет приблизительно пять степеней свободы.
Постоянная Больцмана.
физическая постоянная, определяющая связь между температурой и энергией. Названа в честь австрийского физика Людвига Больцмана, сделавшего большой вклад в статистическую физику, в которой эта постоянная играет ключевую роль. Её экспериментальное значение в Международной системе единиц (СИ) равно:
 Дж/К
Дж/К
Уравнение Клапейрона-Менделеева.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
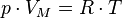 ,
,
где
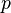 — давление,
— давление, — молярный объём,
— молярный объём, — универсальная газовая постоянная
— универсальная газовая постоянная — абсолютная температура,К.
— абсолютная температура,К.
Так как  , где
, где  — количество вещества, а
— количество вещества, а  , где
, где 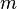 — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
 , где
, где  — количество вещества, а
— количество вещества, а  , где
, где 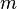 — масса,
— масса,  — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Уравнение, выведенное Клапейроном содержало некую неуниверсальную газовую постоянную  , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:
 , значение которой необходимо было измерять для каждого газа:
, значение которой необходимо было измерять для каждого газа:
Менделеев же обнаружил, что  прямо пропорциональна
прямо пропорциональна  , коэффициент пропорциональности
, коэффициент пропорциональности  он назвал универсальной газовой постоянной.
он назвал универсальной газовой постоянной.
 прямо пропорциональна
прямо пропорциональна  , коэффициент пропорциональности
, коэффициент пропорциональности  он назвал универсальной газовой постоянной.
он назвал универсальной газовой постоянной.Универсальная газовая постоянная.
Газовая постоянная (R) – одна из основных физических постоянных, входит в уравнение состояния 1 моля идеального газа: pV = RT, где р – давление, V – объем моля газа, Т – абсолютная температура. Газовая постоянная численно равна работе расширения 1 моля идеального газа под постоянным давлением при нагревании на 1 K.
R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Dж/(моль•K)




