Внутренняя энергия тела.
Внутренней энергией тела называют сумму кинетической энергии теплового движения его атомов и молекул и потенциальной энергии их взаимодействия между собой.
Пусть газ одноатомный, т.е. состоит из отдельных атомов, а не молекул, например, любой из инертных газов. Тогда кинетическая энергия атомов этого газа равна кинетической энергии их поступательного движения, так как вращательное отсутствует. Поэтому для вычисления внутренней энергии, U одноатомного газа массыm необходимо умножить среднюю кинетическую энергию, ЕСР его атома (см. 23.6) на общее количество, N атомов в газе (см. 19.1 и 19.2):
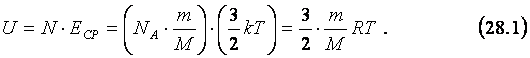 |
Теплота.
Теплота (обозначается Q, также называется количество теплоты) — мера энергии, переходящей от одного тела к другому в процессе теплопередачи. В системе СИ единицей измерения теплоты является джоуль.
Теплообмен.
Теплопередача — физический процесс передачи тепловой энергии от более горячего тела к более холодному либо непосредственно (при контакте), либо через разделяющую (тела или среды) перегородку из какого-либо материала. Когда физические тела одной системы находятся при разной температуре, то происходит передача тепловой энергии, или теплопередача от одного тела к другому до наступления термодинамического равновесия. Самопроизвольная передача тепла всегда происходит от более горячего тела к более холодному, что является следствием второго закона термодинамики
Работа.
А - работа внешних сил - работа сил, сжимающих газ.
А' - работа газа - работа самого газа при расширении.
А = - А'.
Работа расширения пара выталкивает пробку из пробирки.
Величина работы зависит в первую очередь от величины изменения объема газа ΔV.
При ΔV = 0 (неизменном объеме) A = 0.
Величина работы газа равна площади фигуры под графиком на диаграмме pV.
Формулы для вычисления работы при постоянном давлении:
Формулы, где встречается работа:
I начало термодинамики.
Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил
Уравнение теплового баланса.
Если тела образуют замкнутую систему и между ними происходит только теплообмен, то алгебраическая сумма полученных Qnи отданных Q0 энергий равна нулю:
Полученная Qn и отданная Q0 теплоты численно равны, но Qn берется со знаком плюс, a Q0 - со знаком минус.
Теплоемкость.
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплотыδQ, полученного телом, к соответствующему приращению его температуры δT:

Теплоемкости идеального газа и изопроцессах.
Адиабатический [править]
В адиабатическом процессе теплообмена с окружающей средой не происходит, то есть  . Однако, объём, давление и температура меняются, то есть
. Однако, объём, давление и температура меняются, то есть  .
.
 . Однако, объём, давление и температура меняются, то есть
. Однако, объём, давление и температура меняются, то есть  .
.
Следовательно, теплоёмкость идеального газа в адиабатическом процессе равна нулю:  .
.
 .
.Изотермический [править]
В изотермическом процессе постоянна температура, то есть 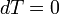 . При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна бесконечности:
. При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна бесконечности: 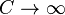
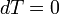 . При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна бесконечности:
. При изменении объёма газу передаётся (или отбирается) некоторое количество тепла. Следовательно, теплоёмкость идеального газа равна бесконечности: 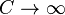
Изохорный [править]
В изохорном процессе постоянен объём, то есть  . Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (
. Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (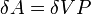 ). Первое Начало Термодинамики для изохорного процесса имеет вид:
). Первое Начало Термодинамики для изохорного процесса имеет вид:
 . Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (
. Элементарная работа газа равна произведению изменения объёма на давление, при котором происходит изменение (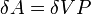 ). Первое Начало Термодинамики для изохорного процесса имеет вид:
). Первое Начало Термодинамики для изохорного процесса имеет вид:
А для идеального газа

Таким образом,

где 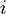 — число степеней свободы частиц газа.
— число степеней свободы частиц газа.
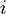 — число степеней свободы частиц газа.
— число степеней свободы частиц газа.Адиабатный процесс в идеальном газе.Уравнения Пуассона.
Для идеального газа:
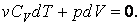 | (4.9.3) |
Отсюда видно, что при адиабатном расширении 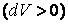 газ охлаждается
газ охлаждается 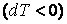 , а при адиабатном сжатии
, а при адиабатном сжатии 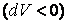 газ нагревается
газ нагревается 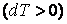 , хотя теплота при этом процессе не подводится и не отводится.
, хотя теплота при этом процессе не подводится и не отводится.
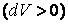 газ охлаждается
газ охлаждается 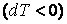 , а при адиабатном сжатии
, а при адиабатном сжатии 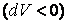 газ нагревается
газ нагревается 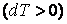 , хотя теплота при этом процессе не подводится и не отводится.
, хотя теплота при этом процессе не подводится и не отводится.
Проинтегрировав, найдем работу, совершаемую идеальным газом при адиабатном процессе.
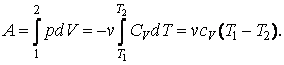 | (4.9.4) |
Теплоемкость 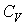 вынесена из-под интеграла, т. к. для идеального газа она не зависит от температуры.
вынесена из-под интеграла, т. к. для идеального газа она не зависит от температуры.
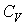 вынесена из-под интеграла, т. к. для идеального газа она не зависит от температуры.
вынесена из-под интеграла, т. к. для идеального газа она не зависит от температуры.
Чтобы найти уравнение адиабаты в переменных 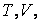 подставим вместо p его выражение из уравнения Менделеева –Клапейрона
подставим вместо p его выражение из уравнения Менделеева –Клапейрона 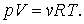 В результате будем иметь
В результате будем иметь
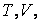 подставим вместо p его выражение из уравнения Менделеева –Клапейрона
подставим вместо p его выражение из уравнения Менделеева –Клапейрона 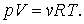 В результате будем иметь
В результате будем иметь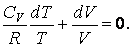 | (4.9.5) |
Интегрирование последнего соотношения дает
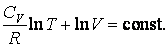 | (4.9.6) |
Откуда находим
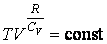 | (4.9.7) |
Выразим величину 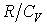 через отношение теплоемкостей
через отношение теплоемкостей 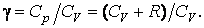 В результате будем иметь
В результате будем иметь 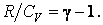 Подставив, получим
Подставив, получим
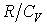 через отношение теплоемкостей
через отношение теплоемкостей 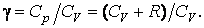 В результате будем иметь
В результате будем иметь 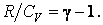 Подставив, получим
Подставив, получим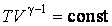 | (4.9.8) |
Последнее соотношение есть уравнение адиабаты (уравнение Пуассона) в переменных T,V. Чтобы записать это уравнение в координатах p,V или T,p нужно произвести замену соответствующих переменных , воспользовавшись уравнением Менделеева – Клапейрона. В результате получим еще два эквивалентных уравнения адиабаты:
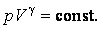 | (4.9.9) |
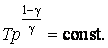 | (4.9.10) |
Выражение для работы можно записать иначе. Для этого уравнение адиабаты представим в виде:
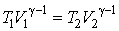 | (4.9.11) |
Отсюда находим
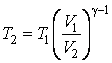 | (4.9.12) |
Подставляя, и учитывая что 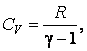 получим
получим
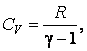 получим
получим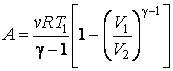 | (4.9.13) |
Из уравнения Пуассона (4.9.9) следует, что давление идеального газа в адиабатном процессе 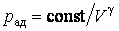 убывает быстрее, чем в изотермическом процессе
убывает быстрее, чем в изотермическом процессе 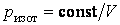 , так как всегда
, так как всегда 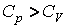 и, таким образом,
и, таким образом,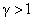 . Физически это объясняется тем, что при адиабатном расширении давление газа уменьшается не только за счет уменьшения объема, но и по причине происходящего при этом понижении температуры. Поэтому и работа против меньшего внешнего давления
. Физически это объясняется тем, что при адиабатном расширении давление газа уменьшается не только за счет уменьшения объема, но и по причине происходящего при этом понижении температуры. Поэтому и работа против меньшего внешнего давления 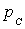 (
( 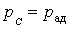 для равновесного процесса) при адиабатном процессе будет меньше, чем работа против большего внешнего давления
для равновесного процесса) при адиабатном процессе будет меньше, чем работа против большего внешнего давления 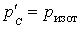 при изотермическом процессе. На рис. 1 работа расширения от объема
при изотермическом процессе. На рис. 1 работа расширения от объема 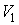 до объема
до объема 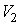 при адиабатном процессе равна площади фигуры
при адиабатном процессе равна площади фигуры 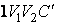 , а при изотермическом – площади фигуры
, а при изотермическом – площади фигуры 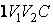 .
.
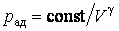 убывает быстрее, чем в изотермическом процессе
убывает быстрее, чем в изотермическом процессе 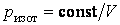 , так как всегда
, так как всегда 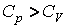 и, таким образом,
и, таким образом,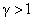 . Физически это объясняется тем, что при адиабатном расширении давление газа уменьшается не только за счет уменьшения объема, но и по причине происходящего при этом понижении температуры. Поэтому и работа против меньшего внешнего давления
. Физически это объясняется тем, что при адиабатном расширении давление газа уменьшается не только за счет уменьшения объема, но и по причине происходящего при этом понижении температуры. Поэтому и работа против меньшего внешнего давления 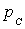 (
( 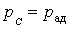 для равновесного процесса) при адиабатном процессе будет меньше, чем работа против большего внешнего давления
для равновесного процесса) при адиабатном процессе будет меньше, чем работа против большего внешнего давления 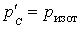 при изотермическом процессе. На рис. 1 работа расширения от объема
при изотермическом процессе. На рис. 1 работа расширения от объема 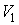 до объема
до объема 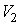 при адиабатном процессе равна площади фигуры
при адиабатном процессе равна площади фигуры 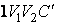 , а при изотермическом – площади фигуры
, а при изотермическом – площади фигуры 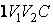 .
.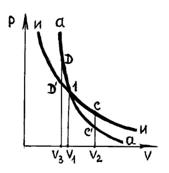 |
| рис. 1 |
Наоборот, при адиабатном сжатии от объема 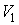 до объема
до объема 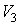 давление газа растет быстрее, чем при изотермическом процессе, так как при адиабатном процессе давление увеличивается не только за счет уменьшения объема, но и вследствие роста температуры газа. Поэтому и работа при адиабатическом сжатии, равная площади фигуры
давление газа растет быстрее, чем при изотермическом процессе, так как при адиабатном процессе давление увеличивается не только за счет уменьшения объема, но и вследствие роста температуры газа. Поэтому и работа при адиабатическом сжатии, равная площади фигуры 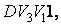 больше работы сжатия при изотермическом процессе, равной площади фигуры
больше работы сжатия при изотермическом процессе, равной площади фигуры 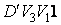 .
.
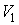 до объема
до объема 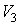 давление газа растет быстрее, чем при изотермическом процессе, так как при адиабатном процессе давление увеличивается не только за счет уменьшения объема, но и вследствие роста температуры газа. Поэтому и работа при адиабатическом сжатии, равная площади фигуры
давление газа растет быстрее, чем при изотермическом процессе, так как при адиабатном процессе давление увеличивается не только за счет уменьшения объема, но и вследствие роста температуры газа. Поэтому и работа при адиабатическом сжатии, равная площади фигуры 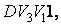 больше работы сжатия при изотермическом процессе, равной площади фигуры
больше работы сжатия при изотермическом процессе, равной площади фигуры 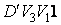 .
. , где γ —
, где γ —